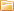Электролизом называется разложение электролита (раствора солей, кислот, щелочей) электрическим током.
Электролизом называется разложение электролита (раствора солей, кислот, щелочей) электрическим током.
Электролиз можно производить только постоянным током. При электролизе на отрицательном электроде (катоде) выделяется водород или металл, содержащийся в соли. Если положительный электрод (анод) выполнен из металла (обычно того же, что и в соли), то положительный электрод при электролизе растворяется. Если анод нерастворим (например, угольный), то содержание металла в электролите при электролизе уменьшается.
Количество вещества, выделяющегося при электролизе на катоде, пропорционально количеству электричества, которое протекло через электролит.
Количество вещества, выделенное одним кулоном электричества, называется электрохимическим эквивалентом A, поэтому G=A•Q; G=A•I•t,
где G – количество выделенного вещества; Q – количество электричества; I – электрический ток; t – время.
Каждый металл имеет свой электрохимический эквивалент A.
Примеры расчета
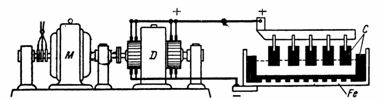
1. Сколько меди выделится из медного купороса (CuSO4) (рис. 1) током I=10 А за 30 мин. Электрохимический эквивалент меди A=0,329 мг/A•сек.
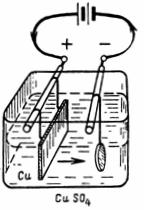
Рис. 1. Схема к примеру 1
G = A•I•t = 0,329•10•30•60 = 5922 мг =5,922 г.
На предмете, подвешенном к катоду, выделится 5,9 г чистой меди.
2. Допустимая плотность тока при электролитическом меднении •=0,4 А/дм2. Площадь катода, которая должна покрыться медью, S=2,5 дм2. Какой ток необходим для электролиза и сколько меди выделится на катоде за 1 ч (рис. 2).
Рис. 2. Схема к примеру 2
I=••S =0,4-2,5=l A; G=A•Q=A•I•t=0,329•1•60•60=1184,4 мг.
3. Окисленная вода (например, слабый раствор серной кислоты H2SO4) при электролизе разлагается на водород и кислород. Электроды могут быть угольные, оловянные, медные и т. д., но лучше всего из платины. Сколько кислорода выделится на аноде и сколько водорода выделится на катоде за 1/4 ч при токе 1,5 А. Количество электричества 1 А•сек выделяет 0,058 см3 кислорода и 0,116 см3 водорода (рис. 3).
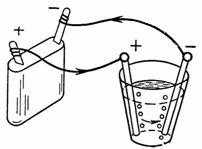
Рис. 3. Схема к примеру 3
На катоде выделится Gа=A•I•t=0,058•1,5•15•60=78,3 см3 кислорода.
На аноде выделится Gк=A•I•t=0,1162•1,5•15•60=156,8 см3 водорода.
Смесь водорода и кислорода в такой пропорции называется гремучим газом, который при поджигании взрывается с образованием воды.
4. Кислород и водород для лабораторных опытов получают при помощи электролиза воды (окисленной серной кислотой) (рис. 4). Платиновые электроды впаяны в стекло. Установим с помощью сопротивления ток I=0,5 А. (В качестве источника тока используется батарея из трех сухих элементов по 1,9 В.) Сколько водорода и кислорода выделится через 30 мин.
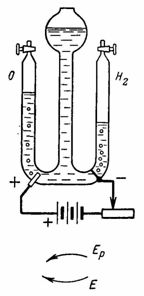
Рис. 4. Рисунок к примеру 4
В правом сосуде выделится Gк=А•I•t=0,1162•0,5•30•60=104,58 см3 водорода.
В левом сосуде выделится Ga=A•l•t=0,058•0,5•30•60=52,2 см3 кислорода (газы выталкивают воду в средний сосуд).
5. Преобразовательная установка (двигатель-генератор) обеспечивает ток для получения электролитической (чистой) меди. За 8 ч необходимо получать 20 кг меди. Какой ток должен обеспечить генератор• Электрохимический эквивалент меди равен A=0,329 мг/А•сек.
Так как G=A•I•t, то I=G/(A•t)=20000000/(0,329•8•3600)=20000000/9475,2=2110,7 А.
6. Нужно отхромировать 200 фар, из которых на каждую требуется 3 г хрома. Какой ток необходим, чтобы эта работа была выполнена за 10 ч (электрохимический эквивалент хрома A=0,18 мг/А•сек).
I=G/(A•t)=(200•3•1000)/(0,18•10•3600)=92,6 А.
7. Алюминий получают путем электролиза раствора каолиновой глины и криолита в ваннах при рабочем напряжении ванны 7 В и токе 5000 А. Аноды изготовляются угольными, а ванна – стальной с угольными блоками (рис. 5).
Рис. 5.Рисунок к примеру 5
Ванны для получения алюминия соединяются последовательно для увеличения рабочего напряжения (например, 40 ванн). Для получения 1 кг алюминия требуется примерно 0,7 кг угольных анодов и 25–30 кВт•ч электроэнергии. По приведенным данным определить мощность генератора, расход электроэнергии за 10 ч работы и вес полученного алюминия.
Мощность генератора при работе на 40 ванн P=U•I=40•7•5000=1400000 Вт =1400 кВт.
Электрическая энергия, расходуемая за 10 ч, A=P•t=1400 кВт 10 ч=14000 кВт•ч.
Количество полученного алюминия G=14000:25=560 кг.
Исходя из теоретического электрохимического эквивалента, количество полученного алюминия должно быть равно:
Gт=A•I•t=0,093•5000•40•10•3600=0,093•7200000000 мг=669,6 кг.
Коэффициент полезного действия электролитической установки равен: кпд=G/Gт =560/669,6=0,83=83%.