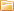В мире, окружающем нас, существует множество веществ, способных проводить электрический ток. Одним из таких классов веществ являются электролиты. Понимание принципов, по которым растворы электролитов становятся проводниками электрического тока, имеет важное значение в различных областях нашей жизни.
Во-первых, знание о проводимости растворов позволяет нам понять, как работает электрохимия. Электролитические процессы, основанные на перемещении заряженных частиц в растворах, являются основой для различных электрохимических явлений, таких как электролиз, электрохимические реакции и гальванические элементы.
Изучение электролитической проводимости помогает нам развить новые технологии и применения в области энергетики, электрохимии и биомедицины.
Во-вторых, электролиты играют важную роль в нашей повседневной жизни. Многие из нас используют электролитические растворы в бытовых приборах, в батарейках и аккумуляторах, которые являются источниками энергии для наших гаджетов и транспортных средств.
Знание о том, почему растворы электролитов могут проводить электрический ток, помогает нам понять принципы работы этих устройств, улучшить их эффективность и разрабатывать новые технологии.
Что такое электролиты и электролитическая проводимость?
Электролиты - это вещества, способные в растворе или плавленом состоянии разлагаться на ионы и обеспечивать проводимость электрического тока. Они играют ключевую роль в электрохимических процессах и являются основой для электролитической проводимости.
Понятие электролитов можно объяснить следующим образом: когда определенное вещество растворяется в воде или другом растворителе, оно разлагается на положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы). Эти ионы являются носителями электрического заряда и способны передвигаться в растворе. Именно движение этих заряженных частиц обеспечивает электролитическую проводимость.
Положительно заряженные ионы называются катионами, а отрицательно заряженные - анионами. Когда мы применяем электрическое напряжение к раствору с электролитом, катионы и анионы начинают двигаться в противоположных направлениях под воздействием электрического поля. Этот поток заряженных частиц составляет электрический ток, который мы наблюдаем в проводящем растворе.
Важно отметить, что электролитическая проводимость зависит от концентрации электролита в растворе. Чем выше концентрация электролита, тем больше ионов доступно для проводимости тока, и тем выше проводимость раствора. Кроме того, величина заряда и мобильность ионов также влияют на электролитическую проводимость.
Как возникает проводимость в растворах?
Проводимость растворов основана на процессах диссоциации и ионизации. Давайте рассмотрим каждый из них подробнее и поймем, как они способствуют передаче электрического тока в растворах.
1. Диссоциация:
Диссоциация происходит, когда молекулы вещества в растворе разлагаются на ионы под воздействием растворителя. Вода является наиболее распространенным растворителем, поэтому рассмотрим процесс диссоциации на примере водных растворов.
Представьте, что у нас есть раствор сольной кислоты (HCl) в воде. При контакте с водой молекулы HCl разлагаются на два иона: положительно заряженный ион водорода (H+) и отрицательно заряженный ион хлорида (Cl-). Эти ионы становятся носителями электрического заряда и могут свободно перемещаться в растворе, обеспечивая проводимость электрического тока.
2. Ионизация:
Ионизация происходит, когда нейтральные молекулы вещества в растворе превращаются в ионы под воздействием растворителя или других факторов, таких как температура или давление. Процесс ионизации может быть наблюдаемым в газообразных и жидких растворах.
Например, если мы рассмотрим раствор кислоты серной (H2SO4), то под воздействием воды молекулы H2SO4 ионизируются, образуя три вида ионов: положительно заряженный ион водорода (H+), два отрицательно заряженных иона сернокислого радикала (HSO4-) и дополнительно два иона воды (H2O). Вновь образованные ионы способны проводить электрический ток.
Когда ионы образуются в растворе, они становятся подвижными и могут перемещаться под воздействием электрического поля. Положительно заряженные ионы (катионы) движутся в положительном направлении, а отрицательно заряженные ионы (анионы) движутся в отрицательном направлении. Это движение ионов создает электрический ток в растворе.
Важно отметить, что скорость ионного перемещения зависит от их заряда и массы, а также от величины и направления приложенного электрического поля. Ионы с более высоким зарядом и меньшей массой могут перемещаться быстрее, чем ионы с меньшим зарядом и большей массой.
Помимо ионной проводимости, существует также и молекулярная проводимость. В случае некоторых веществ, которые не диссоциируют в ионы в растворе, проводимость происходит за счет движения нейтральных молекул. Однако молекулярная проводимость обычно намного ниже, чем ионная проводимость, так как ионы обладают значительно большими подвижностью и зарядом.
Проводимость растворов основана на двух основных процессах - диссоциации и ионизации. Благодаря этим процессам ионы образуются в растворах и могут свободно перемещаться, создавая электрический ток. Понимание этих процессов помогает нам объяснить, почему растворы электролитов проводят электрический ток.
Какое различие электрического тока в металлах от электролитов?
Основное различие между электрическим током в металлах и электролитах связано с типом носителей заряда и механизмами передвижения этих зарядов.
В металлах электрический ток обусловлен передвижением свободных электронов. В кристаллической структуре металлов электроны в валентной зоне могут свободно перемещаться внутри материала.
Под воздействием электрического поля электроны начинают двигаться в определенном направлении, создавая ток. Это называется электронной проводимостью, и она является характерной особенностью металлического проводника.
С другой стороны, в электролитах электрический ток обусловлен передвижением ионов. Электролиты представляют собой вещества, в которых ионы могут свободно перемещаться в растворе.
Когда электролит подвергается воздействию электрического поля, положительно заряженные ионы (катионы) направляются к отрицательно заряженному электроду (аноду), а отрицательно заряженные ионы (анионы) - к положительно заряженному электроду (катоду). Это называется ионной проводимостью, и она характерна для электролитов.
«
Подписывайтесь на наши каналы в Telegram:
Школа для электрика и Электрика, электромонтажные работы
Что влияет на проводимость растворов?
Проводимость растворов может быть существенно изменена под влиянием нескольких факторов, включая температуру и концентрацию электролита. Давайте рассмотрим эти факторы более подробно.
1. Влияние температуры:
Температура играет важную роль в определении проводимости растворов. Обычно с повышением температуры проводимость раствора увеличивается. Это связано с тем, что при повышении температуры молекулярная и ионная подвижность в растворе возрастает. Более высокая энергия, обусловленная повышенной температурой, способствует более активному движению ионов, что ведет к более эффективному проведению электрического тока.
2. Влияние концентрации электролита:
Концентрация электролита, то есть количество растворенных ионов в определенном объеме раствора, также влияет на его проводимость. При увеличении концентрации электролита проводимость раствора обычно увеличивается. Это связано с тем, что большее количество ионов в растворе означает больше носителей заряда, которые могут перемещаться и создавать электрический ток.
Однако существуют пределы, когда увеличение концентрации не приводит к дальнейшему росту проводимости. Это связано с тем, что при очень высокой концентрации электролита ионы становятся ближе друг к другу и начинают взаимодействовать, образуя ионные пары или агрегаты. Это может ограничить их подвижность и, следовательно, уменьшить проводимость раствора.
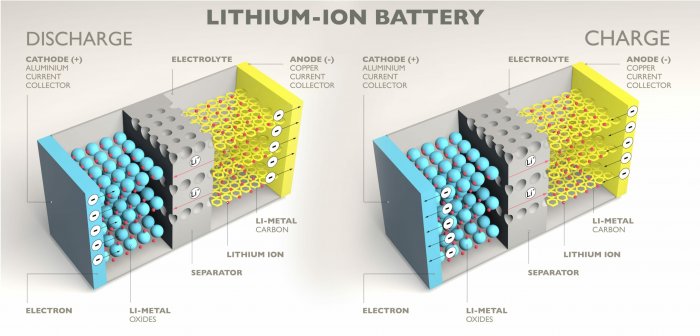
Аккумуляторы
Принцип работы литий-ионных аккумуляторов (Устройство литий-ионных аккумуляторов)
Практическое применение знаний о проводимости растворов
Электролитическая проводимость играет важную роль во многих аспектах нашей повседневной жизни. Ниже представлены некоторые примеры ее применения в науке, медицине и технологии.
1. Научные исследования:
В науке электролитическая проводимость используется для изучения различных материалов и растворов. Измерение проводимости помогает определить химические свойства веществ, исследовать ионные реакции и выявлять особенности ионного перемещения. Это позволяет ученым разрабатывать новые материалы, изучать электрохимические процессы и улучшать существующие технологии.
2. Медицина:
В медицине электролитическая проводимость растворов имеет большое значение для диагностики и лечения. Например, в крови содержатся электролиты, такие как натрий, калий и хлор, которые играют важную роль в поддержании нормального функционирования организма. Измерение электролитов в крови позволяет врачам оценить состояние пациента, контролировать электролитический баланс и принимать соответствующие медицинские меры.
3. Технологии:
Электролитическая проводимость находит широкое применение в различных технологиях. Один из ярких примеров - электролитические аккумуляторы, которые используются в мобильных устройствах, автомобильной промышленности и возобновляемой энергетике. Эти аккумуляторы основаны на перемещении ионов в растворе электролита для хранения и высвобождения энергии.
Кроме того, электролитическая проводимость применяется в электрохимической обработке материалов, электролизе, электрофорезе и других электрохимических процессах.
Смотрите также:
Какие вещества проводят электрический ток
Электрический ток в жидкостях и газах