Аккумуляторные батареи, способные многократно накапливать и отдавать электрическую энергию, стали одним из важнейших изобретений, обеспечивших техническую революцию XIX-XXI веков - от телеграфных станций и подводных лодок до современных электромобилей и смартфонов.
История развития аккумуляторов началась в 1859 году с первого перезаряжаемого свинцово-кислотного элемента французского физика Гастона Планте и прошла через этапы совершенствования электродов, изменения химического состава и миниатюризации, достигнув апогея в создании литий-ионной технологии Джоном Гуденафом в 1980 году, удостоенной Нобелевской премии в 2019 году.
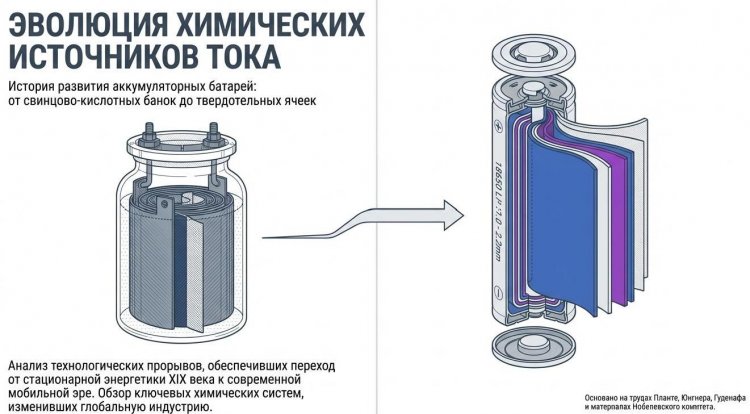
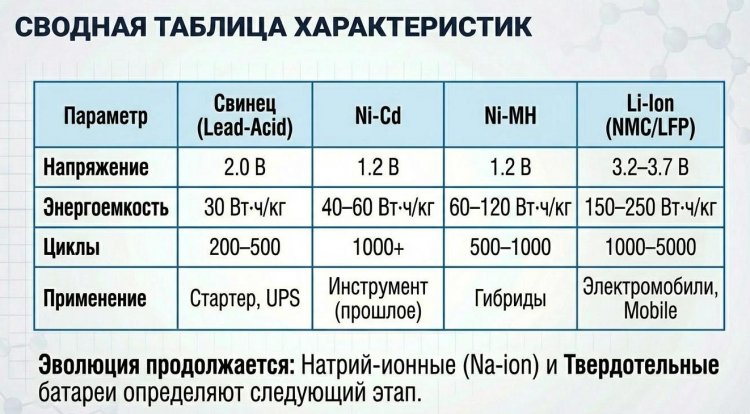
За полтора столетия эволюции удельная энергия аккумуляторов выросла с 20-30 Вт·ч/кг у свинцовых до 250-300 Вт·ч/кг у литий-ионных, срок службы увеличился с сотен до тысяч циклов заряда-разряда, а масса снизилась на порядок при той же емкости.
Никель-кадмиевые батареи Вальдмара Юнгнера (1899), никель-металлогидридные элементы 1980-х и революционные литий-ионные системы позволили реализовать мобильные устройства, электрический транспорт и накопители энергии для солнечных и ветровых электростанций, трансформировав глобальную энергетику и транспорт.
Современные литий-железо-фосфатные батареи (LiFePO4) с повышенной безопасностью и твердотельные элементы будущего, разрабатываемые в 2020-х, обещают удвоение плотности энергии и сокращение времени зарядки до минут, открывая перспективы электрификации авиации и полной декарбонизации транспорта к 2050 году.
В настоящей статье представлен хронологический обзор развития аккумуляторных технологий с описанием ключевых изобретений, принципов работы, областей применения и перспектив, иллюстрирующий путь от громоздких свинцовых банок к компактным литий-полимерным ячейкам, питающим цифровую цивилизацию XXI века.
Изобретение свинцово-кислотного аккумулятора Гастоном Планте (1859)
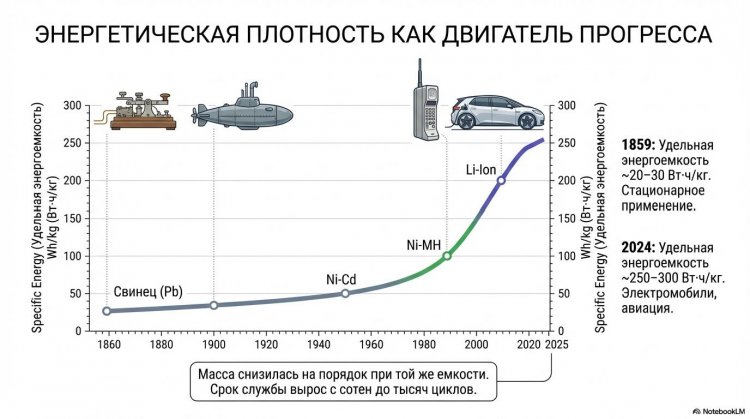
Первый в мире перезаряжаемый аккумулятор был изобретен французским физиком Гастоном Планте (Gaston Plante, 1834-1889), сотрудником лаборатории Александра Эдмона Беккереля в Париже, в 1859 году - в том же году, когда Дарвин опубликовал "Происхождение видов", а Франция и Австрия заключили Виллафранкский мир.
Предыстория изобретения восходит к 1800 году, когда Алессандро Вольта создал "Вольтов столб" - первый химический источник тока, состоявший из медных и цинковых пластин, разделенных тканью, смоченной кислотой, что положило начало эре электричества.
В 1836 году британец Джон Дэниэлл усовершенствовал конструкцию, создав элемент с медным и цинковым электродами в сульфатных растворах, но все эти устройства были первичными - после разрядки их нельзя было восстановить.
В 1860 году русский академик Борис Якоби первым применил принцип вторичных батарей для телеграфных целей, пропуская обратный ток через разряженный элемент и восстанавливая его работоспособность, но не дал практической конструкции.
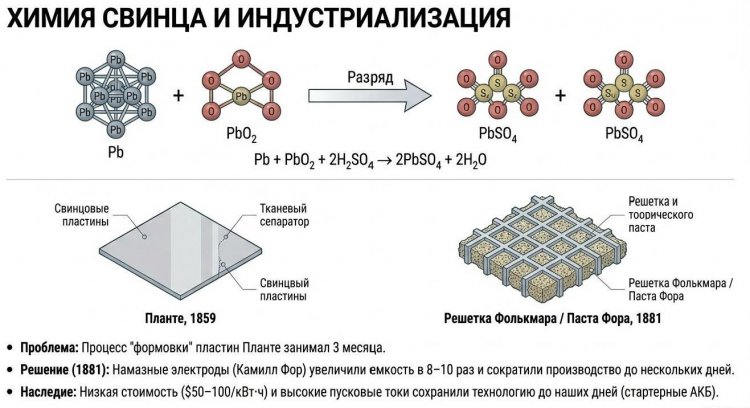
Планте воспользовался этой идеей и создал устройство, состоявшее из двух тонких свинцовых пластин площадью около 1 м2, проложенных тканью (сепаратором), намотанных на деревянный цилиндр диаметром 5-7 см и погруженных в стеклянную банку с 10%-ным раствором серной кислоты H2SO4.
При пропускании тока от внешнего источника (батареи Вольта) на положительном электроде образовывался диоксид свинца PbO2 коричневого цвета, на отрицательном оставался чистый свинец Pb, а в электролите концентрировалась серная кислота. При разряде протекала обратная реакция: Pb + PbO2 + 2H2SO4 -> 2PbSO4 + 2H2O, выделяя энергию.
Первые свинцовые аккумуляторы Планте обладали мизерной емкостью - около 1 А·ч при напряжении 2 В, что едва хватало для питания одной лампы Яблочкова на 10-15 минут, поэтому говорить о практическом применении было рано.
Однако Планте заметил, что емкость возрастает с увеличением площади поверхности, контактирующей с электролитом, и что многократные циклы заряда-разряда с изменением полярности (процесс формовки) повышают емкость в 5-10 раз за счет образования губчатых оксидов свинца с развитой поверхностью - но этот процесс занимал три месяца и сотни циклов.
В 1878-1881 годах француз Камилл Фор (Camille Alphonse Faure) революционизировал технологию, предложив намазные электроды: на свинцовую решетку наносилась паста из оксидов свинца (PbO, PbO2, Pb3O4) с серной кислотой, что увеличило начальную емкость в 8-10 раз и сократило формовку до нескольких дней.
В 1881 году немец Эрнст Фолькмар (Ernst Volkmar) предложил использовать намазную решетку с ячейками, ставшую стандартом конструкции.
К концу XIX века свинцово-кислотные батареи нашли применение в телеграфных станциях, первых электромобилях (Camille Jenatzy на "La Jamais Contente" достиг 105 км/ч в 1899 году), на подводных лодках и в системах аварийного освещения.
В России производство началось в 1881 году в Кронштадте под руководством инженеров Морского ведомства. Свинцовые аккумуляторы сохранили актуальность до XXI века благодаря низкой стоимости (50-100 долл/кВт·ч), простоте конструкции, способности выдавать большие токи (до 1000 А при пуске двигателя) и устойчивости к перезаряду, применяясь в автомобильных стартерных батареях, источниках бесперебойного питания UPS, солнечных и ветровых накопителях.
Никель-кадмиевые батареи Вальдмара Юнгнера (1899)
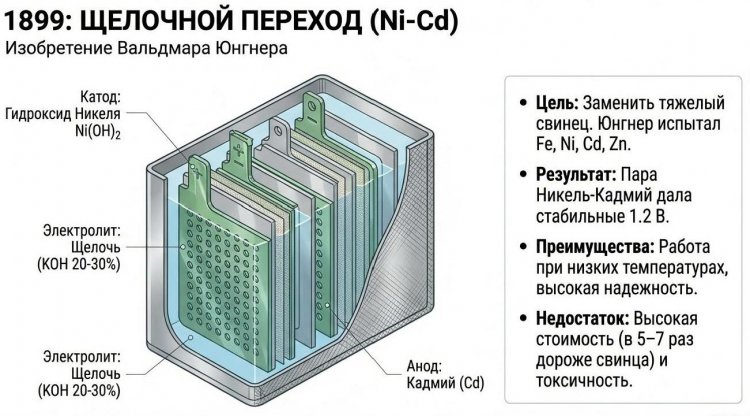
В 1899 году, на исходе XIX столетия, шведский изобретатель Вальдмар Юнгнер (Waldemar Jungner, 1869-1924) запатентовал никель-кадмиевый аккумулятор - первую щелочную систему, превосходящую свинцовые по удельной энергии, числу циклов и морозостойкости.
Юнгнер экспериментировал с различными материалами электродов в щелочном электролите (гидроксид калия KOH 20-30%), пытаясь найти альтернативу дорогому и тяжелому свинцу; он испытал железо, никель, кадмий, цинк и обнаружил, что пара никель-кадмий дает наибольшее напряжение (1,2 В) и стабильные характеристики.
Конструкция включала положительный электрод из гидроксида никеля Ni(OH)2, осажденного в пористой никелевой матрице, отрицательный - из кадмия Cd в той же матрице, сепаратор из нейлона или полипропилена и щелочной электролит; реакция записывалась: Cd + 2Ni(OH)3 -> Cd(OH)2 + 2Ni(OH)2.
Юнгнер получил шведские патенты № 8558/1897, 10177/1899, 11132/1899 и германский № 110210/1899, но технология оказалась дороже свинцовой в 5-7 раз из-за цены никеля и кадмия, поэтому коммерциализация шла медленно.
Первые применения в 1900-1910-х охватили железнодорожную сигнализацию в Швеции, горную технику (устойчивость к вибрации и низким температурам), аварийное освещение и радиоаппаратуру.
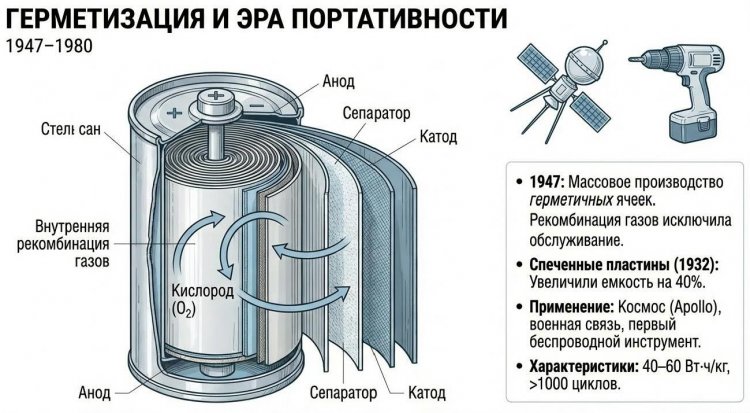
Прорыв произошел в 1932 году, когда немецкие инженеры разработали спекание активного материала в пористых никелевых пластинах под давлением 200-300 атм при температуре 900-1000°C, что повысило механическую прочность и емкость на 30-40%.
С 1947 года в США и Европе началось серийное производство герметичных никель-кадмиевых батарей, где газы, образующиеся при перезаряде (кислород на положительном электроде, водород на отрицательном), рекомбинировали внутри без выхода наружу благодаря специальному клапану давления и избытку отрицательного электрода, что исключило необходимость долива электролита и обслуживания.
Это сделало Ni-Cd батареи идеальными для портативной техники: в 1950-1960-х они питали военные радиостанции, космические аппараты (спутники серии "Спутник" и Apollo), электроинструмент.
Преимущества включали удельную энергию 40-60 Вт·ч/кг (в 1,5-2 раза выше свинцовых), число циклов 1000-2000, работу при -40°C до +60°C, способность отдавать большие токи. Недостатками были "эффект памяти" (снижение емкости при неполной разрядке), токсичность кадмия и высокая стоимость.
Никель-металлогидридные аккумуляторы (1980-е)
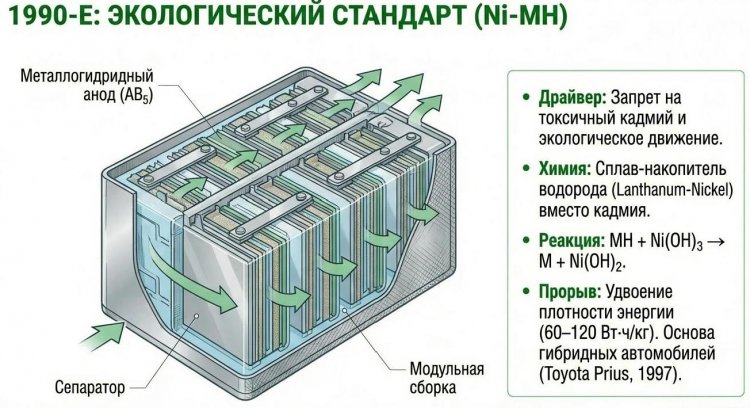
В 1980-х годах, на волне экологического движения и запретов на кадмий в Европе, появились никель-металлогидридные (Ni-MH) аккумуляторы, где кадмиевый отрицательный электрод заменен сплавом, поглощающим водород, - обычно LaNi5 (интерметаллид лантана и никеля) или AB5-типа, способным обратимо абсорбировать до 1,5% водорода по массе.
Разработка началась в 1970-х в Philips и Sanyo на основе исследований водородных аккумуляторов для военных подлодок, но коммерциализация произошла в 1989-1990 годах с выпуском цилиндрических элементов формата AA Matsushita и Sanyo. Химия включала положительный электрод Ni(OH)3, отрицательный - металлогидридный сплав MH, электролит KOH; реакция: MH + Ni(OH)3 -> M + Ni(OH)2.
Ni-MH батареи превзошли Ni-Cd по удельной энергии (60-120 Вт·ч/кг против 40-60), полностью исключили токсичный кадмий, снизили эффект памяти на 70-80%, что сделало их популярными в портативной электронике 1990-х - цифровых камерах, ноутбуках, беспроводных телефонах.
В автомобильной индустрии Ni-MH батареи стали основой первых массовых гибридов: Toyota Prius (1997) с батареей на 1,3 кВт·ч обеспечивала запас хода 50 км в электрорежиме, Honda Insight (1999), Ford Escape Hybrid (2004) использовали Ni-MH до появления Li-ion в 2010-х.
Недостатки включали высокий саморазряд (20-30% в месяц против 10% у Ni-Cd), чувствительность к перезаряду (нагрев до 60-70°C), ограниченное число циклов 500-1000 и высокую стоимость металлогидридных сплавов (лантан, церий).
Литий-ионные батареи Джона Гуденафа (1980-1991)
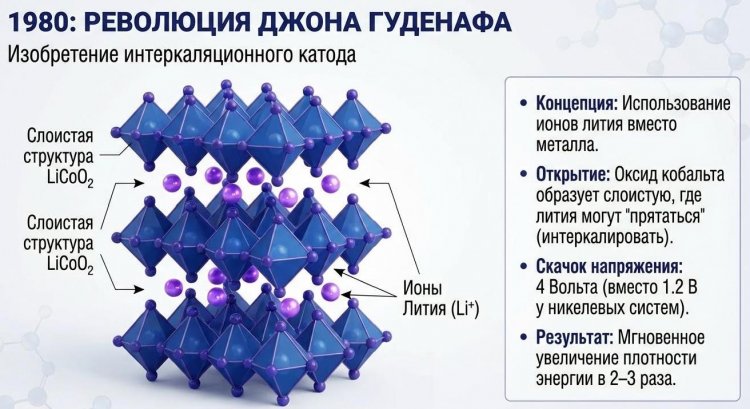
Революция в аккумуляторных технологиях началась в 1980 году, когда британо-американский физик Джон Б. Гуденаф (John B. Goodenough, 1922-2023), профессор Оксфордского университета, синтезировал катод из слоистого оксида лития-кобальта LiCoO2, ставший основой современных литий-ионных батарей.
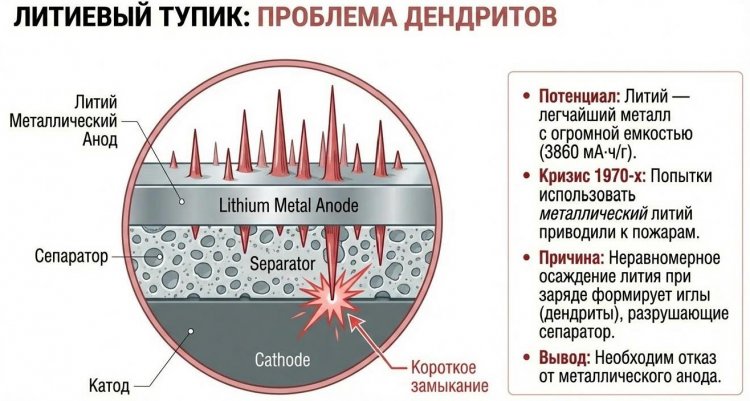
Предпосылки создания включали энергетический кризис 1973-1979 годов, стимулировавший поиск альтернатив бензину, и исследования литиевых первичных батарей 1970-х, использовавших металлический литий в качестве анода с высокой теоретической емкостью 3860 мА·ч/г, но страдавших от дендритов - игольчатых наростов лития, пробивавших сепаратор и вызывавших короткие замыкания и пожары.
Гуденаф, работавший над проблемой с 1976 года, предложил революционную концепцию: использовать вместо металлического лития литий-ионы, мигрирующие между двумя интеркаляционными электродами - катодом и анодом, способными обратимо внедрять и извлекать Li+ без разрушения структуры.
В рамках четырехлетнего проекта он создал LiCoO2 со слоистой структурой, где атомы кобальта Co3+ чередуются со слоями оксидов кислорода O2-, между которыми располагаются "карманы" для ионов лития; при зарядке ионы Li+ покидают катод, восстанавливая Co3+ до Co4+, и мигрируют к аноду, при разряде - возвращаются. Этот катод обеспечивал напряжение 4,0-4,2 В против 1,2-1,5 В у Ni-Cd/Ni-MH, что дало удельную энергию 150-200 Вт·ч/кг - в 2-3 раза больше любых существовавших систем.
Однако Оксфордский университет отказался патентовать открытие Гуденафа, посчитав его непрактичным, и тот передал права британской Atomic Energy Research Establishment (AERE), которая лицензировала технологию японским компаниям.
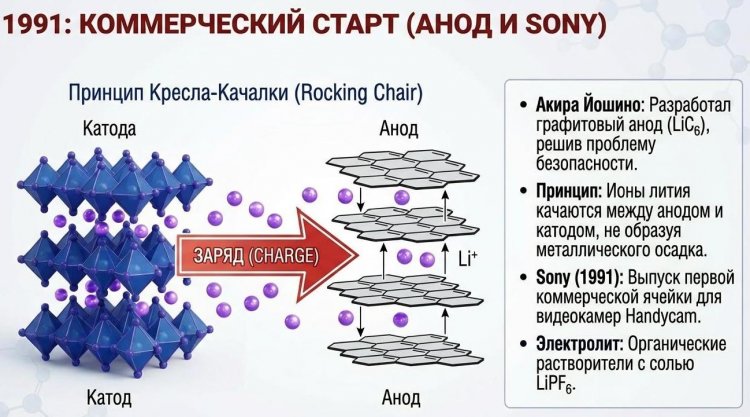
В 1980-х японский химик Акира Йошино (Akira Yoshino) из Asahi Kasei добавил второй ключевой элемент - графитовый анод, способный интеркалировать литий с емкостью 372 мА·ч/г по формуле LiC6, заменив опасный металлический литий. Он также разработал безопасный электролит на основе карбонатов (этиленкарбонат + диметилкарбонат) с солью LiPF6.
В 1991 году Sony выпустила первую коммерческую литий-ионную батарею на 500 мА·ч для видеокамеры Handycam, положив начало мобильной эре. В 2019 году Гуденаф, Йошино и Стэнли Уиттингем получили Нобелевскую премию по химии за создание литий-ионной технологии; Гуденаф стал старейшим лауреатом в 97 лет и продолжал исследования до смерти в 2023 году в возрасте 100 лет.
Применение в электромобилях и накопителях энергии
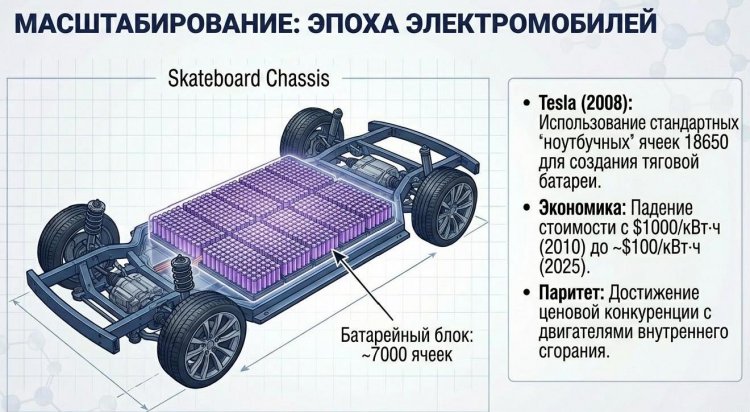
Литий-ионные батареи трансформировали транспорт и энергетику с 2000-х годов. В автомобилях первопроходцем стал Tesla Roadster (2008) с батареей на 53 кВт·ч из 6831 цилиндрических ячеек 18650, обеспечивавших запас хода 400 км - в 2-3 раза больше Ni-MH гибридов; затем Nissan Leaf (2010), Chevrolet Volt (2011), BMW i3 (2013), массовая Model 3 (2017) с батареей 75 кВт·ч и запасом 500 км.
К 2025 году литий-ионные электромобили составили 15-20% мировых продаж (18 млн штук), вытесняя ДВС благодаря снижению стоимости батарей с 1000 долл/кВт·ч в 2010 году до 100-150 долл/кВт·ч в 2025 году - порог рентабельности.
В накопителях энергии Li-ion системы стали ключевыми для интеграции солнечных и ветровых станций: Tesla Powerwall (13,5 кВт·ч) для домов, Tesla Megapack (3 МВт·ч) для промышленных объектов, проект Hornsdale Power Reserve в Австралии (150 МВт, 194 МВт·ч) стабилизируют сети, накапливая энергию днем и отдавая ночью, снижая зависимость от ископаемого топлива на 30-40%. К 2030 году прогнозируется установка накопителей на 500-600 ГВт·ч, обеспечивая 25-30% мирового энергобаланса от ВИЭ.
Литий-железо-фосфатные батареи и твердотельные технологии будущего
Литий-железо-фосфатные (LiFePO4 или LFP) батареи, разработанные в середине 1990-х в MIT Джоном Гуденафом и Акшайей Падхи, стали альтернативой LiCoO2 с повышенной безопасностью: катод из оливина LiFePO4 не разлагается при перегреве до 400°C (LiCoO2 - при 150°C), исключая возгорание.
Удельная энергия ниже (90-120 Вт·ч/кг против 150-250 у NMC/NCA), но число циклов достигает 3000-5000, стоимость на 20-30% ниже из-за отсутствия кобальта, что сделало LFP популярными в электробусах (BYD K9, 324 кВт·ч), стационарных накопителях и бюджетных электромобилях (Tesla Model 3 Standard Range с LFP с 2021 года).
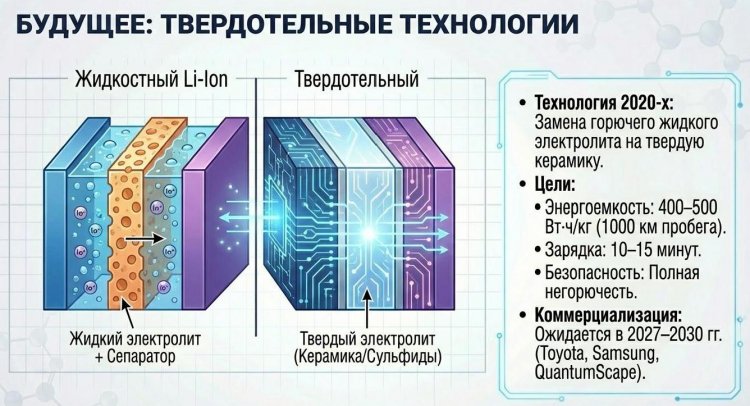
Твердотельные батареи с твердым электролитом (керамика на основе LLZO или сульфиды) вместо жидкого - прорыв 2020-х, обещающий удельную энергию 400-500 Вт·ч/кг (в 1,5-2 раза выше Li-ion), зарядку за 10-15 минут, полную негорючесть и срок службы 10000 циклов.
Toyota, QuantumScape, Samsung анонсировали коммерциализацию к 2027-2030 годам для премиальных электромобилей с запасом хода 1000 км. Натрий-ионные батареи (Na-ion) CATL с 2023 года для бюджетных сегментов с энергией 160 Вт·ч/кг используют дешевый натрий вместо лития, снижая стоимость на 30-40%.
Эволюция от свинцовых "банок" Планте к твердотельным ячейкам революционизировала цивилизацию, обеспечив мобильность и связь.
Повный Андрей Владимирович, преподаватель Филиала УО Белорусский государственный технологический университет "Гомельский государственный политехнический колледж"

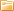



 Телеграмм каналы для тех, кто каждый день хочет узнавать новое и интересное:
Телеграмм каналы для тех, кто каждый день хочет узнавать новое и интересное: