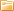Законы электролиза Фарадея представляют собой количественные соотношения, основанные на электрохимических исследованиях Майкла Фарадея, которые он опубликовал в 1836 году.
Данные законы определяют связь между количеством веществ, выделяющихся при электролизе и количеством электричества, которое прошло при этом через электролит. Законов Фарадея два. В научной литературе и в учебниках встречаются различные формулировки данных законов.
Электролиз — выделение из электролита входящих в его состав веществ при прохождении электрического тока. Так, например, при пропускании электрического тока через слегка подкисленную воду вода разлагается на составные части — газы (кислород и водород).
Количество выделившегося из электролита вещества пропорционально количеству протекшего через электролит электричества, т. е. произведению из силы тока на время, в течение которого этот ток протекал. Поэтому явление электролиза может служить для измерения силы тока и определения единицы силы тока.
Электролит — раствор и вообще сложная жидкость, проводящая электрический ток. В аккумуляторах электролитом служит раствор серной кислоты (в свинцовых) или раствор едкого калия, либо едкого натра (в железоникелевых). В гальванических элементах электролитом служат также растворы каких-либо химических соединений (нашатыря, медного купороса и т. п.).
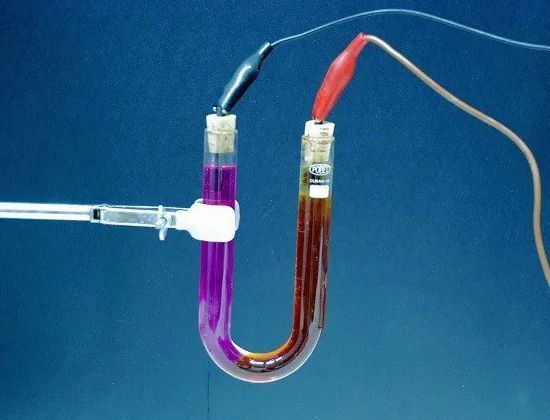
Майкл Фарадей (1791 - 1867)
Майкл Фарадей (1791 — 1867) — английский физик, основатель современного учения об электромагнитных явлениях. Начал свою трудовую жизнь учеником в переплетной мастерской. Получил только начальное образование, но самостоятельно изучая науки и работая лаборантом у химика Деви, стал великим ученым, одним из самых крупных физиков-экспериментаторов.
Фарардей открыл явление электромагнитной индукции, законы электролиза, разработал учение об электрических и магнитных полях и заложил основы современных представлений об электромагнитном поле. Он был первым ученым, у которого возникла мысль о колебательном, волновом характере электромагнитных явлений.
Первый закон электролиза Фарадея
Масса вещества, которое осядет на электроде при электролизе, прямо пропорциональна количеству электричества, переданного к этому электроду (прошедшего через электролит). Под количеством электричества понимается количество электрического заряда, который обычно измеряется в кулонах.
Второй закон электролиза Фарадея
Для определенного количества электричества (электрического заряда) масса химического элемента, который осядет на электроде при электролизе, прямо пропорциональна эквивалентной массе данного элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
Или
Одно и то же количество электричества приводит к выделению на электродах при электролизе эквивалентных масс различных веществ. Для выделения одного моля эквивалента любого вещества необходимо затратить одно и то же количество электричества, а именно 96485 Кл. Данная электрохимическая константа называется числом Фарадея.
Законы Фарадея в математической форме
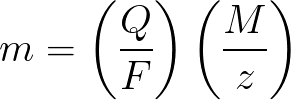
-
m – масса вещества, осевшего на электроде;
-
Q – величина полного электрического заряда в кулонах, который прошел при электролизе;
-
F = 96485,33(83) Кл/моль — число Фарадея;
-
M- молярная масса элемента в г/моль;
-
z – валентное число ионов вещества (электронов на ион);
-
M/z – эквивалентная масса осевшего на электроде вещества.
Применительно к первому закону электролиза Фарадея, M, F и z – константы, поэтому чем больше будет Q, тем больше окажется и m.
Применительно ко второму закону электролиза Фарадея, Q, F и z – константы, поэтому чем больше будет M/z, тем больше окажется m.
Для постоянного тока имеем
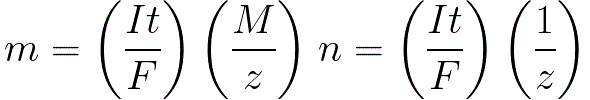
-
n – количество молей (количество вещества), выделенного на электроде: n = m/M.
-
t – время прохождения постоянного тока через электролит Для переменного тока суммируется полный заряд за время.
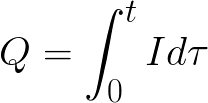
-
t – полное время электролиза.
Пример применения законов Фарадея
Необходимо записать уравнение электрохимических процессов на катоде и аноде при электролизе водного раствора сульфата натрия при инертном аноде. Решение задачи будет таким. В растворе сульфат натрия станет диссоциировать по такой схеме:
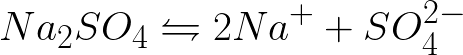
Стандартный электродный потенциал в данной системе таков:
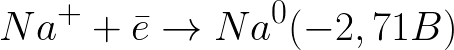
Это значительно более отрицательный уровень потенциала нежели для водородного электрода в нейтральной среде (-0,41 В). Поэтому на отрицательном электроде (катоде) начнет протекать электрохимическая диссоциация воды с выделением водорода и гидроксид-иона по следующей схеме:
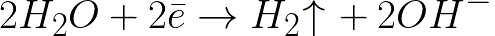
А положительно заряженные ионы натрия, подходящие к отрицательно заряженному катоду, станут скапливаться возле катода, в прилегающей к нему части раствора.
На положительном электроде (аноде) будет протекать электрохимическое окисление воды, что приведет к выделению кислорода, по следующей схеме:
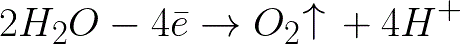
В данной системе стандартный электродный потенциал +1,23 В, что сильно ниже стандартного электродного потенциала, характерного для следующей системы:
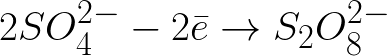
Отрицательно заряженные сульфат-ионы, бегущие к положительно заряженному аноду, станут скапливаться в пространстве возле анода.
Андрей Повный